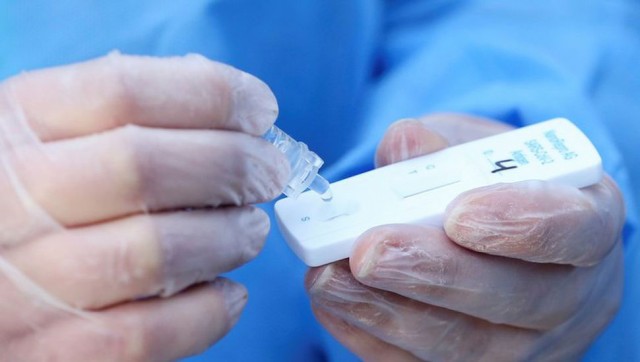
La Facultad de Bioquímica y Ciencias Biológicas (FBCB) adhiere al comunicado del Ente Coordinador de Unidades Académicas de Farmacia y Bioquímica (ECUAFYB), emitido el 22 de abril, donde expresa su preocupación ante la ANMAT por la reciente autorización que permite la comercialización en farmacias de los nuevos Kits de detección de antígenos de SARS-CoV-2 en secreciones nasales y de garganta.
Fundamentos de la solicitud
“La Ley de Educación Superior reguló las carreras de interés público y de acuerdo a las actividades reservadas establecidas en la Res. ME 1254/18 Anexo XVII, corresponde a los profesionales bioquímicos realizar, certificar, e interpretar análisis clínicos que contribuyan a la prevención, diagnóstico, pronóstico y tratamiento de las enfermedades de los seres humanos y a la prevención de la salud.
Dado que la enfermedad por Covid19 fue incorporada a partir de la Resolución N° 680 del Ministerio de Salud de la Nación a partir del día 30 de marzo del 2020 como enfermedad de denuncia obligatoria, toda notificación epidemiológica debe incorporarse en el Sistema Integrado de Información Sanitaria Argentino (SISA), como manera de realizar una adecuado seguimiento de la pandemia.
Nos preocupa que, de no establecerse un adecuado control en la dispensa y utilización del mencionado test de diagnóstico, se incurrirá en la pérdida de información epidemiológica fundamental para la toma de decisiones.
Por otra parte, se pondría en riesgo cierto a la salud de las personas que los utilicen y a la salud pública por no poder garantizar el adecuado control de una correcta toma de muestra, la correcta interpretación de los resultados, la trazabilidad del reactivo en caso de fallas por almacenamiento inadecuado y, la eliminación de material patógeno con los residuos domiciliarios. Considerando además, que el ámbito de la Farmacia no es el definido para la venta de productos/reactivos de uso profesional que no son de venta libre y, que la venta de estos productos podría escapar al debido control que asegure que quien lo adquiera, concurra de manera efectiva a un Laboratorio Bioquímico para realizarse la práctica, convirtiéndolo de hecho, en un producto de autoevaluación para lo cual no está diseñado ni autorizado.
También es preocupante la difusión pública, avalada por otros profesionales de la salud, donde se sugiere y apoya que estos test rápidos se realicen en los hogares y que podrían comprarse en Farmacias.
Por último, la Disposición ANMAT 9688/2019 que regula el registro de productos médicos, establece en el artículo 22° inc. b que la condición de uso exclusivo a profesionales e instituciones sanitarias, corresponde a aquellos productos médicos que debido a su riesgo intrínseco, o en razón de su modo de uso, o a las medidas colaterales necesarias para su uso, no resultan seguros si no son utilizados por un profesional habilitado para utilizar dicho producto de acuerdo con sus incumbencias profesionales (productos de uso profesional exclusivo). Estos productos sólo podrán ser vendidos a profesionales e instituciones sanitarias, o bajo prescripción o por cuenta y orden de los mismos.
Por lo expuesto, consideramos que la mencionada autorización podría obstaculizar el control correcto y oportuno de la enfermedad por COVID-19, teniendo en cuenta la normativa y la situación sanitaria, solicitamos que en dicha resolución sea modificado el canal de dispensa para garantizar los mecanismos de control responsable que se ejercen cuando las actividades las realizan los/las profesionales con título habilitante”.
Firman el comunicado: Cristina Arranz, presidenta de ECUAFYB y Federico Giraudo.
vicepresidente.